CÓMO DEFIENDE NUESTRO CUERPO SU ÓRGANO MÁS GRANDE
Y no es el cerebro, aunque sí tiene que ver con el asunto
Cuando pensamos en órganos, solemos pensar en los que están dentro del cuerpo, como los pulmones o el hígado. Pero a menudo nos olvidamos del órgano más grande y que está más a la vista de todos: la piel. Con un peso aproximado de 3,5 kg, la piel rodea todo nuestro cuerpo, ocupando una superficie de la friolera de 2 metros cuadrados. Es la barrera que nos separa del mundo exterior, previniendo que nos deshidratemos y muramos de frío o calor. A nivel inmunológico es una pesadilla: una enorme zona fronteriza, expuesta a todo tipo de patógenos que estarían muy cómodos y calentitos si nos consiguieran colonizar. Por no hablar de la a radiación y las sustancias químicas, que pueden contribuir a iniciar un cáncer cuando menos nos lo esperemos. Y toda esta actividad defensiva debe ser manejada con guante de seda, sin que la cosa se nos vaya de las manos en forma de inflamación indeseada.
Pero ¿quién se encarga de la defensa de la piel?
Pues precisamente, por lo complicado que es organizar un sistema de defensa en semejante campo de batalla, también es más difícil comprenderlo una vez organizado. Quizá por eso la inmunología de la piel es una de las especialidades que siguen dándonos sorpresas cada poco tiempo con nuevos descubrimientos.
Pero vamos por partes: antes de deleitarnos con los descubrimientos recientes, debemos familiarizarnos con los anteriores. En primer lugar, debemos saber qué células inmunes patrullan nuestra piel. Pues tenemos a los macrófagos, de quienes hablamos no hace mucho, que pertenecen a la sección de la inmunidad innata (es decir, más primitiva y sin memoria). Y en segundo lugar están las células dendríticas, más sofisticadas y que combinan características de inmunidad innata y adaptativa (esta última es la que guarda memoria de los patógenos). En general, las células dendríticas son expertas en hacer de centinelas, vigilando el órgano en el que están alojadas por si aparecen patógenos; y, si los encuentran, son capaces de presentar en su superficie trocitos de estos microbios, que sirven para alertar a otras células del sistema inmunitario, como las células T y B. Pues bien, en la piel, con su gran superficie y exposición a patógenos, se encuentran las “fuerzas especiales” de las células dendríticas. Son unas células dendríticas altamente especializadas en su papel de centinelas fronterizos, algunas de las cuales incluso han desarrollado resistencia a la radiación (por ejemplo, las células de Langerham).
Al igual que pasa con los macrófagos en los pulmones, a las células dendríticas de la piel también se les puede ir la mano, provocando inflamación ante un falso atacante. En este caso, la inflamación desbocada resulta en patologías como la psoriasis o la dermatitis atópica, que vuelven locos a los dermatólogos por su dificultad de tratamiento y recurrencia en el tiempo.
¿Y qué pinta el cerebro en todo esto?
Vamos llegando al meollo de los nuevos descubrimientos de los que os quería hablar hoy. Por si la inmunología de la piel no fuera suficientemente complicada de por sí, ahora encima se ha metido el sistema nervioso de por medio. Y lo ha hecho en forma de los nociceptores (y yo que pensaba que los inmunólogos poníamos nombres feos, pues se ve que los neurólogos nos ganan). Con nombre bonito o feo, se trata de unas terminaciones neuronales (es decir, ramificaciones que llegan desde el cerebro hasta la piel) encargadas de percibir alteraciones térmicas, mecánicas o químicas que pueden resultar peligrosas para el cuerpo. Al notar estas alteraciones, provocan un estímulo que se traduce en forma de dolor o picor. A estas alturas, imagino que no hace falta que os diga que uno de los órganos donde son más necesarios los nociceptores es la piel.
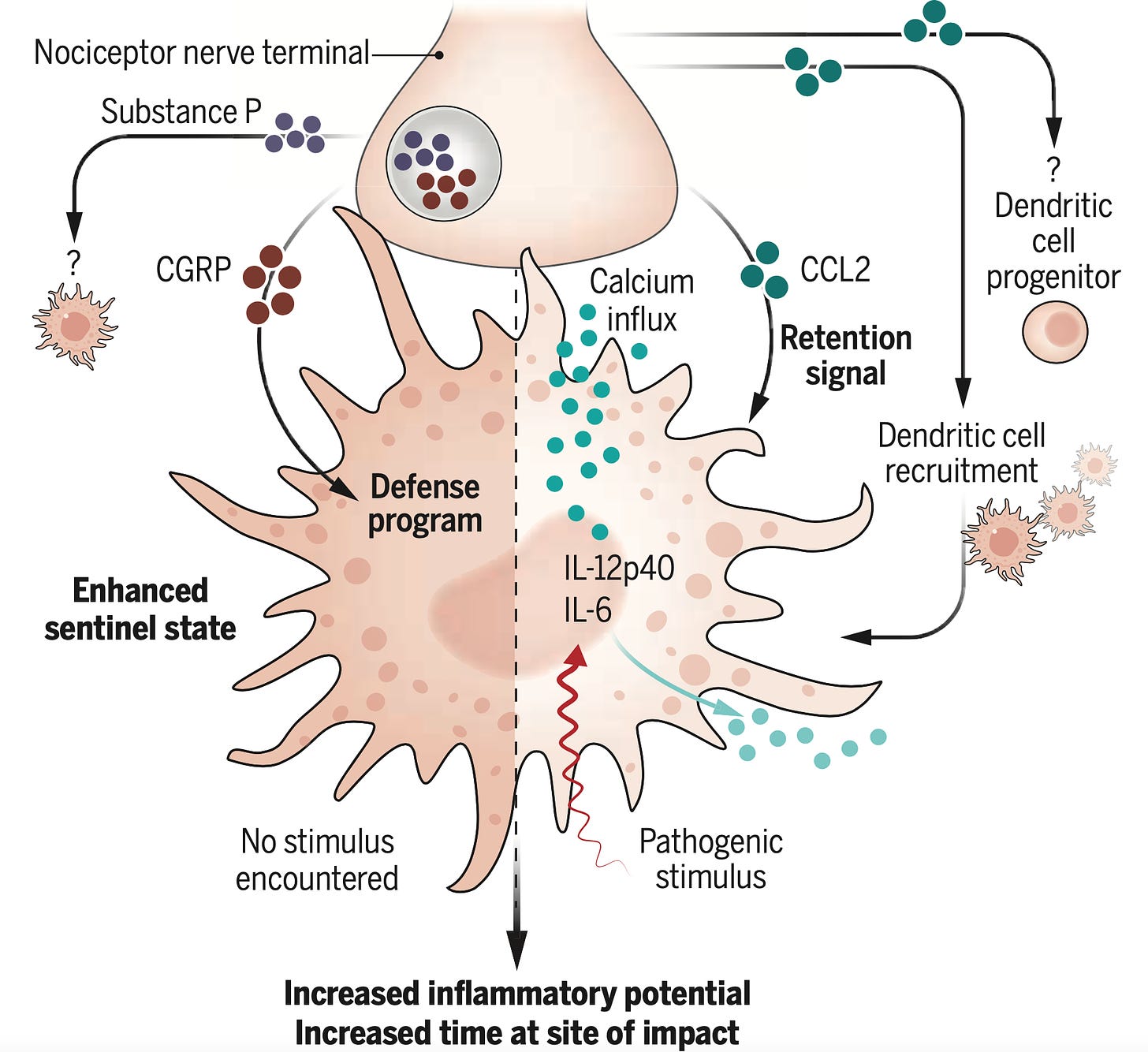
Pues bien, lo que se ha visto es que los nociceptores son capaces de comunicarse con las células dendríticas, y están en estrecho contacto con ellas. Dependiendo del contexto, pueden actuar sobre ellas de tres modos distintos:
1) Atraerlas y marcar el tiempo que deben permanecer en la piel;
2) Ordenarles mantenerse en modo “centinela”, vigilando la aparición de patógenos, pero sin sobreactuar;
3) Lanzar una señal de peligro que hace que la célula dendrítica se active en ausencia de un estímulo inmunológico, llamando a otras células inmunes y causando inflamación.
Esquema de la actuación de los nociceptores sobre las células dendríticas. Fuente: “Tuning centinel immune cells” por B.U. Schraml.
Estas interacciones pueden darse bien a través de secreción de sustancias químicas, o bien por medio de estímulos eléctricos directos. Al no ser iniciado por la presencia de un patógeno concreto, este tipo de relación entre el sistema inmunitario y el nervioso entra dentro de la actividad inmune innata de las células dendríticas en la piel. Aparte de esto, estas células también detectan y “fichan” patógenos ellas solitas, sin ayuda del cerebro, para avisar a los mamporreros del sistema inmunitario (aquí ya se trata de actividad inmune adquirida). Y ¿qué sentido tiene esta doble vida de las células dendríticas? Pues, probablemente, la activación por nociceptores anticipa los futuros ataques por patógenos como consecuencia del daño en la piel causado por alteraciones mecánicas o térmicas.
Un sistema tan sofisticado de inmunidad innata no podía irse de rositas sin tener su lado oscuro. Ya sabemos que, en los pulmones, el exceso de inmunidad innata puede resultar en una tormenta de citoquinas. En este caso que nos ocupa, la contrapartida al funcionamiento adecuado sería una sobreactivación de las células dendríticas por los nociceptores, resultante en patologías como la psoriasis o la dermatitis. Con suerte, estas nuevas investigaciones facilitarán el desarrollo de nuevas herramientas para luchar contra este tipo de patologías.



Fantástica explicación, te doy un par de apuntes que seguro que los conoceras, pero me gustaría compartilos contigo: Se ha demostrado que la sustancia P puede estimular la proliferación de fibroblastos de médula ósea (Rameshwar et al., 1997), la quimiotaxis de los monocitos humanos (Ruff et al., 1985) y la producción de radicales libres en neutrófilos humanos (Tanabe et al., 1996). Además, se ha demostrado que la sustancia P puede estimular la producción de interleucina-6 en macrófagos alveolares (Zhu et al., 1996) y la producción de interleucina-12 en células T (Weinstock y Elliott, 1998). Estos estudios sugieren que la sustancia P puede desempeñar un papel en la regulación de la producción de ciertas citoquinas, como la IL-18 y la IL-12, que a su vez pueden influir en la expresión de receptores NK-1 en las células T. Esto podría tener implicaciones en el desarrollo de enfermedades autoinmunes, así como en el desarrollo de metástasis óseas en el cáncer de mama.